Ingin mempelajari konfigurasi elektron secara lebih mendalam? Kamu bisa menyimak baik-baik pembahasan berikut. Setelahnya, kamu bisa mengerjakan kuis berupa latihan soal untuk mengasah kemampuan.
Lewat pembahasan ini, kamu bisa belajar mengenai Konfigurasi Elektron. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal dalam bentuk pdf pada link dibawah ini:
Definisi
Pendistribusian atau susunan elektron-elektron di sekeliling inti atom.
Materi Konfigurasi Elektron
Pengertian konfigurasi elektron adalah pengambarkan susunan elektron dalam orbital- orbital atom. Dengan mengetahui hal ini, jumlah elektron pada kulit terluar dapat ditentukan. Banyaknya jumlah elektron terluar (elektron valensi) dari suatu atom menentukan sifat-sifat kimia suatu unsur.
Konfigurasi elektron dapat dituliskan dengan cara:
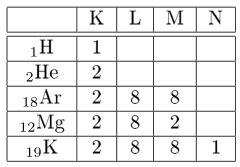
1. Berdasarkan Kulit
Berdasarkan kulit, dapat digunakan rumus konfigurasi elektron $2n^{2}$, di mana n menunjukkan kulit atom.
Contoh: $_{11}Na$: 2, 8, 1
Penulisan konfigurasi dengan cara ini memiliki keterbatasan yaitu hanya berlaku untuk unsur-unsur golongan logam utama.
2. Berdasarkan Konfigurasi Elektron Subkulit.
a. Prinsip Aufbau
Prinsip ini menyatakan bahwa pengisian elektron dimulai dari tingkat energi terendah menuju tingkat energi yang lebih tinggi. Bila digambarkan maka sebagai berikut:
Beberapa kaidah yang harus diikuti dalam penentuannya adalah
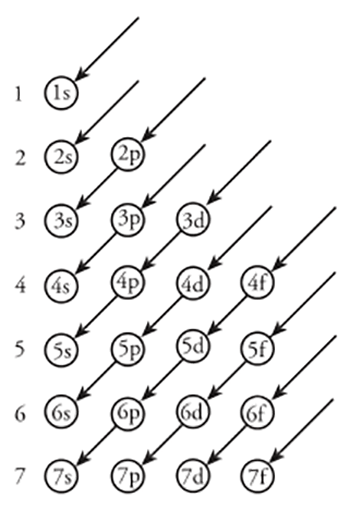
Urutan pengisian orbital mengacu pada arah urutan panah, yaitu 1s, 2s, 2p, 3s, 3p dan sterusnya.
b. Aturan Hund
Hund menyatakan bahwa elektron yang mengisi sub kulit dengan jumlah orbital lebih dari satu akan tersebar pada orbital yang mempunyai kesamaan energi dengan arah putaran (spin) yang sama.
Sub-kulit yang mengandung lebih dari 1 orbital adalah p, d, dan f. Sehingga untuk pengisian orbital-orbitalnya, elektron dengan spin yang sama (menghadap atas semua atau ke bawah semua) masuk terlebih dulu memenuhi orbital sebelum masuk pada posisi spin yang berlawanan (berpasangan), sebagai contoh:
$_{7}N$ : $1s^{2}2s^{2}2p^{3}$Diagram orbital untuk $2p^{3}$:
![]() Sementara untuk $_{7}N^{-}$ (mendapat 1 elektron):
Sementara untuk $_{7}N^{-}$ (mendapat 1 elektron):
![]() Aturan Aufbau dan Hund memiliki beberapa pengecualian antara lain
Aturan Aufbau dan Hund memiliki beberapa pengecualian antara lain
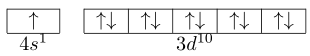
- konfigurasi $ns^{1}(n-1)d^{5}$lebih stabil daripada $ns^{2}(n-1)d^{4}$, karena konfigurasi stengah penuh ns dan (n-1)d lebih stabil. Contohnya untuk atom $_{24}Cr$. Menurut hasil percobaan onfigurasi yang tepat adalah $3d^{5}4s^{1}$, BUKAN $3d^{4}4s^{2}$.
- konfigurasi $ns^{1}(n-1)d^{10}$lebih stabil daripada $ns^{2}(n-1)d^{9}$, karena konfigurasi penuh (n-1)d lenih stabil.
c. Larangan Pauli
Pauli menyatakan bahwa tidak ada 2 elektron dalam satu atom yang mempunyai keempat bilangan kuantum sama. Sehingga bila terdapat 2 elektron yang menempati orbital yang sama (nilai n, l dan m sama) maka mereka akan memiliki nilai spin yang berlawanan tanda (-1/2 dan +1/2)
![]()
Sehingga dapat ditentukan elektron valensinya, yaitu elektron yang terletak pada kulit terluar suatu atom yang nantinya terlibat dalam pembentukan ikatan kimia. Contohnya:
$_{7}N$ : $1s^{2}2s^{2}2p^{3}$, mempunyai elektron valensi 5.
Contoh Soal dan Jawabannya
- Tentukan konfigurasi elektron untuk unsur-unsur berikut
- $_{11}A$
- $_{15}B$
- $_{26}C$
- $_{36}D$
Jawaban- $_{11}A$ : $1s^{2}2s^{2}2p^{6}3s^{1}$
- $_{15}B$ : $1s^{2}2s^{2}2p^{6}3s^{2}3p^{3}$
- $_{26}C$ : $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2}3d^{6}$
- $_{36}D$ : $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2}3d^{10}4p^{6}$
- Tentukan jumlah elektron tak berpasangan yang terdapat di dalam atom $_{29}X$ !
Jawaban
$_{29}X$ : $[Ar]4s^{2}3d^{9}$
kurang tepat, ingat aturan konfigurasi penuh/setengah penuh untuk orbital d:$_{29}X:[Ar]4s^{1}3d^{10}$Bila digambarkan diagram orbital elektron valensinya:

Terdapat 1 elektron yang tidak berpasangan di atom ini.