Kalau kamu tertarik untuk mempelajari tentang Hukum Pertama Termodinamika, simak pembahasannya di sini. Kami juga telah menyiapkan kuis berupa latihan soal dengan tingkatan yang berbeda-beda agar kamu bisa mempraktikkan materi yang telah dipelajari.
Lewat pembahasan ini, kamu bisa belajar mengenai Hukum Pertama Termodinamika. Kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Hukum Pertama Termodinamika pdf pada link dibawah ini:
Definisi
Pengertian asas kekekalan energi adalah asas yang menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan.
Pengertian reaksi eksoterm adalah reaksi yang membebaskan kalor. Pengertian reaksi endoterm adalah reaksi yang menyerap kalor.
Asas Kekekalan Energi
Pertanyaan umum yang keluar dalam materi ini adalah apa yang dimaksud kekekalan energi berikan contohnya! Untuk menjawab soal ini penjelasannya adalah sebagai berikut:
Ketika kita membakar minyak, dilepaskan sejumlah energi panas yang disebut juga kalor. Kalor ini akan menyebabkan lingkungan sekitar menjadi lebih panas. Namun ketika api sudah padam keadaan menjadi normal kembali. Lalu, hilang kemanakah kalor yang dihasilkan tadi?
Ternyata kalor yang dihasilkan dari pembakaran tersebut tidaklah hilang begitu saja, melainkan diserap oleh molekul di udara maupun benda lain di lingkungan sekitar. Demikian pula kalor yang dilepaskan dari pembakaran berasal dari energi kimia yang tersimpan di dalam minyak tersebut.
Inilah contoh berlakunya asas kekekalan energi, yang menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi dapat diubah ke bentuk lain.
Energi tidak dapat diciptakan atau dimusnahkan, tetapi dapat diubah ke bentuk lain.
– Asas Kekekalan Energi
Reaksi Eksoterm dan Endoterm
1. Sistem dan Lingkungan
Dalam termokimia, reaksi atau proses yang menjadi pusat perhatian kita disebut sistem. Segala sesuatu yang berada di sekitar sistem disebut lingkungan.
Untuk menjawab pertanyaan jelaskan pengertian sistem dan lingkungan! bisa dijelaskan dengan uraian berikut:
Sebagai contoh sistem dan lingkungan dalam kehidupan sehari hari jika sepotong pita magnesium kita masukkan ke dalam larutan asam klorida, teramati bahwa gelas reaksi menjadi panas. Campuran magnesium dan HCl adalah sistem, sementara gelas kimia serta udara sekitarnya adalah lingkungan. Oleh sebab itu perubahan yang bisa teramati adalah perubahan pada lingkungan.
Berdasarkan kemungkinan perpindahan materi dan energi maka sistem dapat dibagi menjadi:
- Sistem terbuka: dapat mengalami perpindahan materi dan energi dengan lingkungan, contoh: beaker terbuka
- Sistem tertutup : hanya dapat mengalami perpindahan energi dengan lingkungan, contoh: beaker tertutup rapat
- Sistem terisolasi : tidak dapat mengalami perpindahan materi maupun energi dengan lingkungan. contoh: termos
2. Konsep Entalpi
Sesuai hukum kekekalan energi, perubahan energi dalam yang terlibat dalam suatu proses atau reaksi kimia dapat dituliskan sebagai:
$\Delta E=q+w$ … (1)
Apabila sistem reaksi ini berlangsung dalam sistem tertutup dengan volume tetap ($\Delta V=0$), maka sistem tidak melakukan kerja (ingat bahwa $q=-P\times\Delta V$), sehingga persamaan (1) dapat dituliskan menjadi:
$\Delta E=q_{v}$ ($q_{v}=$ kalor pada volume tetap)
Sehingga semua perubahan energi dalam yang menyertai sistem akan muncul sebagai kalor saja.
Sementara itu bila reaksi berjalan dalam tekanan tetap (kalor dituliskan sebagai $q_{p}$)
$\Delta E=q_{p}+w$
Maka untuk suatu sistem reaksi yang berjalan pada tekanan tetap ditentukan suatu istilah baru, yang disebut Entalpi , dilambangkan H, nilai perubahannya sama besar dengan kalor reaksi.
$\Delta H=q_{\mbox{reaksi}}$
Perubahan entalpi inilah yang lebih sering digunakan dalam termokimia karena sebagian besar reaksi kimia berlangsung pada tekanan tetap, yakni tekanan atmosfir.
3. Eksoterm dan Endoterm
Apabila suatu sistem reaksi melepaskan kalor ke lingkungan, reaksi ini disebut sebagai reaksi eksoterm. Ciri khasnya ditandai dengan timbulnya panas di dalam lingkungan. Sebagai contoh adalah reaksi netralisasi antara asam dan basa akan menimbulkan panas. Pada reaksi ini, tingkat energi produk lebih rendah dari pereaksi, maka
$\begin{aligned}\Delta H & =H_{\mbox{produk}}-H_{\mbox{pereaksi}}\\
& =-
\end{aligned}
$
Bila digambarkan dalam diagram energi reaksi:
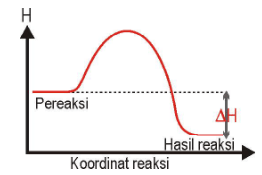
Sebaliknya suatu sistem reaksi endoterm akan menyerap energi dari lingkungannya, dan pengamatan yang tercatat adalah turunnya suhu lingkungan. Pada reaksi ini tingkat energi produk lebih tinggi dari pereaksi, maka
$\begin{aligned}\Delta H & =H_{\mbox{produk}}-H_{\mbox{pereaksi}}\\
& =+
\end{aligned}
$
Diagram energi reaksinya:

4. Persamaan Termokimia
Nilai perubahan entalpi beserta sifat reaksi sangat menentukan dalam penulisan persamaan termokimia dari suatu sistem/reaksi.
Pengertian persamaan termokimia adalah persamaan reaksi yang mengikutsertakan perubahan entalpinya. Nilai $\Delta H$ yang dituliskan pada persamaan termokimia disesuaikan dengan stoikiometri reaksi. Sehingga sebagai contoh penulisan persamaan termokimia yang tepat:
$\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{H}_{2}\mbox{O}(l)$
$\Delta H=-286$ kJ
Contoh Soal Hukum Pertama Termodinamika dan Pembahasannya
- Manakah yang mempunyai energi dalam lebih besar:
— 1 L air ($25^{\circ}$C, 1 atm) atau 2 L air ($25^{\circ}$C, 1 atm)
— 1 L air ($25^{\circ}$C, 1 atm) atau 1 L air ($35^{\circ}$C, 1 atm)
Jawaban
Besar energi dalam suatu zat atau sistem terutama ditentukan oleh jumlahnya, suhu dan tekanan
— pada jumlah yang lebih besar, tentu 2 L air akan memiliki energi dalam lebih besar
— pada suhu yang lebih tinggi, air dengan suhu $35^{\circ}$C akan memiliki energi dalam lebih besar
– - Dalam suatu proses, sistem melepas kalor sebanyak 125 kJ dan menerima kerja sebesar 500 J. Tentukan nilai $q,w,\Delta E$ pada proses ini!
Jawaban
Melepas kalor, maka $q$ akan bertanda negatif
$q=-125\mbox{ kJ}$ Menerima kerja, maka $w$ akan bertanda positif
$w=+0,5\mbox{kJ}$ Sehingga nilai perubahan energinya
$\begin{aligned}\Delta E & =q+w\\
& =-125+0,5\mbox{ kJ}\\
& =-124,5\mbox{ kJ}
\end{aligned}
$
– - Melalui suatu percobaan diketahui bahwa untuk menguraikan 1 mol amonia menjadi gas nitrogen dan gas hidrogen diperlukan kalor 46 kJ.
Tuliskan persamaan termokimia yang tepat untuk reaksi ini!
Jawaban
“Diperlukan” berarti reaksi penguraian ini termasuk reaksi endoterm. Maka, penulisan persamaan termokimia yang tepat adalah$\mbox{NH}_{3}(g)\rightarrow\frac{1}{2}\mbox{N}_{2}(g)+\frac{3}{2}\mbox{H}_{2}(g)$
$\Delta H=+46$ kJ
– - Diketahui persamaan reaksi berikut :
$2\mbox{SO}_{2}(g)+\mbox{O}_{2}(g)\rightarrow2\mbox{SO}_{3}(l)$ beserta dilepaskannya kalor sebesar 198 kJ. Berapakah perubahan entalpi yang akan teramati jika sulfur trioksida yang terbentuk sebanyak 20 gram? (Ar O = 16, S =32).
Jawaban
“Dilepaskan”, berarti reaksi ini termasuk reaksi eksoterm, dengan nilai $\Delta H=-198$ kJ setiap 2 mol $\mbox{SO}_{3}$ terbentuk.
Maka, pertama-tama kita hitung jumlah mol yang terbentuk pada percobaan yang ditanyakan, lalu dibandingkan dengan nilai entalpi pada percobaan standar.Dalam 20 gram terdapat $=\frac{20}{80}=0,25\mbox{ mol}$
Sehingga perubahan entalpi yang menyertai pembentukan 0,25 mol $SO_{3}$adalah:$\begin{aligned}\Delta H & =\frac{0,25}{2}\times(-198\mbox{kJ)}\\
& =-24,75\mbox{kJ}
\end{aligned}
$
