Sistem periodik unsur merupakan salah satu materi kimia yang cukup menarik untuk dibahas. Kalau kebetulan kamu ingin belajar tentang materi ini lebih dalam, simak penjelasan lengkapnya berikut. Kami juga telah menyediakan soal latihan yang bisa dikerjakan untuk mengasah kemampuanmu.
Lewat pembahasan ini, kamu bisa belajar mengenai Sistem Periodik Unsur. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Sistem Periodik Unsur dalam bentuk pdf pada link dibawah ini:
Definisi
Daftar unsur-unsur yang disusun dengan aturan tertentu berdasarkan kemiripan sifatnya.
Untuk belajar materi sistem periodik unsur kamu dapat dowonload modul .pdf diatas dan menguji kemampuanmu dengan kuis interaktif dibawah ini atau mengerjakan kumpulan soal sistem periodik unsur dalam tiga tingkat kesulitan (mudah, sedang, dan sukar).
Perkembangan Sistem Periodik Unsur
Untuk mempermudah proses pembelajaran unsur-unsur para ilmuwan melakukan pengelompokan unsur, yang apabila dirunut berdasarkan perkembangannya adalah sebagai berikut.
1. Pengelompokan oleh Lavoisier
Hukum Lavoisier diperkenalkan oleh ilmuan dengan nama Lavoisier yang merupakan salah satu ilmuwan pertama yang melakukan pengelompokan unsur, meski masih dalam sistem yang sederhana yakni berdasarkan perbedaan sifat fisisnya.
Dalam tabel periodik lavoisier pengelompokan dengan cara melihat kemampuan suatu unsur menghantarkan panas atau listrik. Unsur yang mampu menghantarkan panas disebut unsur logam (contoh tembaga, besi) sementara unsur yang tidak mampu menghantarkan panas disebut unsur non-logam (contoh: oksigen, nitrogen, hidrogen).
Jadi bisa dikatakan sistem periodik unsur kimia berawal dari hukum lavoisier.
2. Triade Dobereiner
J.W Dobereiner adalah ilmuwan pertama yang mengelompokkan unsur berdasarkan perbedaan massa atomnya. Ia menyatakan bahwa setiap golongan terdiri atas tiga unsur, dan unsur yang terletak di tengah mempunyai massa atom yang besarnya mendekati rata-rata dari massa atom unsur pertama (yang lebih rendah dari unsur kedua) dan ketiga (lebih tinggi dari unsur kedua). Kelompok tiga unsur inilah yang disebut triade, oleh sebab itu teori Dobereiner disebut juga Hukum Triade Dobereiner.
Jika gambar tabel periodik unsur kimia sekarang yang kita gunakan adalah penyempurnaan dari perkembangan sistem periodik unsur yang tidak singkat.
3. Hukum Oktaf Newlands
Pada 1864, John Alexander Newlands menyusun suatu tabel berdasarkan kenaikan massa atomnya. Setelah disusun terlihat bahwa ada kemiripan sifat yang berulang setiap delapan unsur dimana unsur kedelapan memiliki sifat mirip dengan unsur pertama.
Sedangkan unsur kedua mirip dengan kesembilan dan seterusnya. Oleh karena mirip dengan tangga nada yang berjarak 1 oktaf, penemuan Newlands ini juga sering disebut Hukum Oktaf yang hingga kini turut bekontribusi dalam perkembangan sistem periodik unsur.
Tabel Newlands yang lengkap dapat dilihat sebagai berikut

4. Tabel periodik Mendelev
Pada 1869 ilmuwan dari Negara Jerman Julius Lothar Meyer dan ilmuwan Rusia Dmitry Mendeleyev mengembangkan penemuan Newlands berkaitan dengan pengulangan sifat unsur secara periodik. Mendeleyev mempublikasikan temuannya lebih dahulu dari Meyer, karena itulah tabel periodik ini lebih kita kenal sebagai Tabel Mendeleyev yang merupakan perkembangan penting pada sistem periodik unsur.
Penggolongan unsur menurut Mendeleyev masih berdasarkan sifat-sifat kimia unsur. Unsur-unsur dengan sifat yang mirip diletakkan pada suatu kolom yang disebut golongan. Selain berdasarkan kemiripan sifat, Mendeleyev juga menentukan urutan unsur berdasarkan kenaikan massa atom. Meski demikian ia berpendapat bahwa urutan unsur berdasarkan kemiripan sifat lebih utama dibandingkan kenaikan massa atomnya.
Disinilah terdapat kelemahan dimana unsur dengan massa yang lebih besar terletak sebelum unsur dengan massa atom lebih kecil. Contohnya adalah peletakan Te (Tellurium) dan I (Iodin), untuk lebih jelas dapat dilihat pada tabel Mendeleyev berikut:
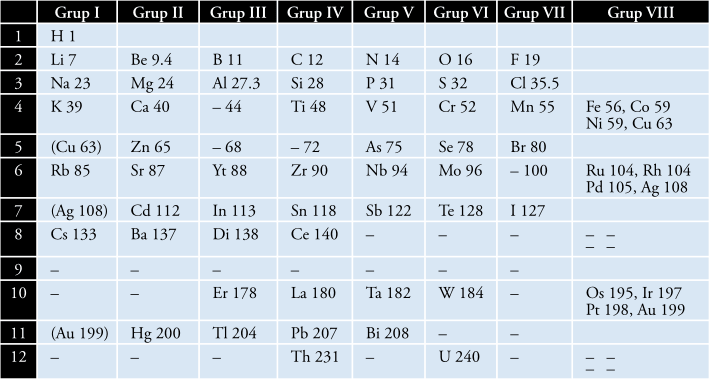
5. Tabel Periodik Modern
Pada 1941 Henry Moseley menyelidiki secara sistematis spektrum sinar X dan mengetahui adanya hubungan antara panjang gelombang sinar X dengan nomor atomnya, dari hasil penyelidikannya Moseley memodifikasi tabel periodik Mendeleyev dan menyusun unsur-unsur berdasarkan kenaikan nomor atomnya.
Tabel inilah yang kita gunakan saat ini dan dikenal sebagai tabel periodik modern. Dengan tabel ini sebenarnya sudah sangat membantu dalam kita memahami atau yang sering ditanyakan siswa/i ialah cara menghafal tabel periodik ini, ya tentunya dengan membaca dan mempelajari dengan saksama. Dan yang lebih penting adalah coba untuk melakukan cara membaca tabel periodik dengan benar yang tentunya bisa dimulai dengan memahami istilah dan kode-kode zat kimia.
Berikut sistem periodik unsur lengkap yang sering kita gunakan khususnya dalam belajar materi sistem periodik unsur.

Organisasi Tabel Periodik
Dalam tabel periodik modern, unsur-unsur disusun dalam:
1. Golongan
Unsur-unsur yang memiliki kesamaan jumlah elektron valensi disusun dalam satu lajur vertikal yang disebut golongan. Unsur yang berada pada satu golongan cenderung memiliki kemiripan sifat kimia. Secara umum golongan dibagi menjadi golongan utama (IA-VIIIA) dan golongan transisi (IB-VIIIB). Nama-nama trivial untuk golongan utama dapat dilihat sebagai berikut.

Tabel berikut menunjukkan hubungan golongan dengan blok unsur dan elektron valensinya.
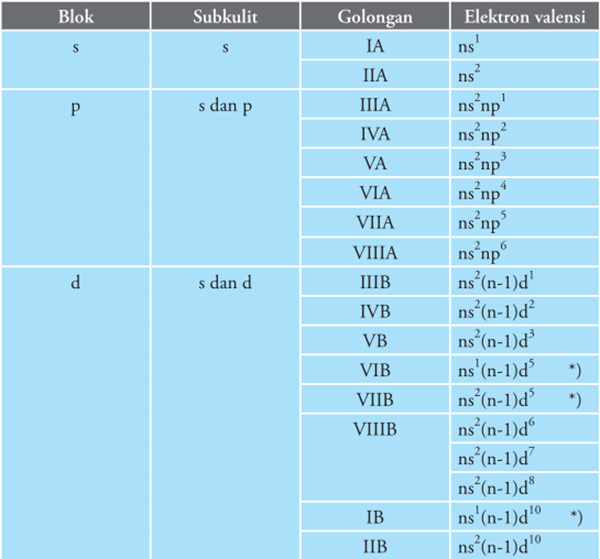
2. Periode
Dalam tabel periodik modern dari atas ke bawah terdapat 7 lajur horizontal yang disebut periode, karena sifat-sifat yang dimiliki unsur-unsur dalam satu periode berulang secara periodik.
Unsur dengan jumlah kulit yang sama disusun dalam 1 periode. Jumlah unsur dalam tiap periode berbeda, yaitu:
- Periode 1: terdapat 2 unsur
- Periode 2 dan 3 : terdapat 8 unsur
- Periode 4 dan 5 terdiri atas 18 unsur
- Periode 6 dan 7 terdiri atas 32 unsur (termasuk lantanida dan aktinida)
Contoh Soal Sistem Periodik Unsur dan Penjelasannya
1. Jabarkan kelemahan masing-masing sistem pengelompokan unsur sebelum tabel periodik modern!
Jawaban
- Lavoisier: terlalu sederhana dan tidak menjelaskan kemiripan sifat unsur
- Dobereiner: tidak semua unsur dapat digolongkan ke dalam triade
- Newlands: terdapat banyak penyimpangan, terutama untuk unsur-unsur dengan massa yang berat
- Mendeleyev: tidak dapat menjelaskan peletakan Te dan I, banyak unsur diletakkan pada golongan dan periode yang sama, contoh pada golongan VIII periode 4
2. Sebuah triade dari unsur A, B dan C diketahui memiliki massa rata-rata 25. Tentukan massa masing-masing unsur bila selisih massa C dan A adalah 15!
Jawaban
$\begin{alignedat}{1}\frac{A+B+C}{3} & =25\\
A+B+C & =75\\
\frac{A+C}{2} & =B\\
A+C & =2B\\
2B+B & =75\\
B & =25
\end{alignedat}
$
Berikutnya
$\begin{alignedat}{1}C-A & =15\\
C & =15+A\\
A+25+15+A & =75\\
2A & =35\\
A & =17,5
\end{alignedat}
$
Sehingga C= 32,5
