Ingin mempelajari materi kimia, khususnya tentang teori dan model atom? Supaya lebih paham, kamu bisa menyimak pembelajarannya di sini. Kamu juga bisa mengerjakan soal latihan untuk mempraktikkan materi yang telah dijelaskan.
Lewat pembahasan ini, kamu bisa belajar mengenai Teori & Model Atom. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tentunya menarik, bukan? Penjelasan yang didapatkan bisa dipraktikkan secara langsung. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal teori dan model atom dalam bentuk pdf pada link dibawah ini:
Definisi
Perihal berkembangnya teori, yakni pendapat yang didasarkan pada penelitian dan penemuan, didukung oleh data dan argumentasi, tentang atom, suatu unsur kimia terkecil yang dapat berdiri sendiri dan dapat bersenyawa dengan yang lain.
Perkembangan Teori dan Model Atom
1. Model Democritus dan Leusipus
Democritus dan Leusipus pada tahun 400 SM menyatakan bahwa suatu materi memiliki bagian terkecil yang disebut atom, istilah dari bahasa Yunani atomos, yang berarti ‘tidak dapat dibagi lagi’.
Pendapatnya ini ditentang oleh banyak pemikir ternama saat itu, seperti Plato dan Aristoteles yang berpendapat bahwa materi bersifat kontinu dan dapat dibelah menjadi bagian lebih kecil secara terus-menerus.
2. Model Atom Dalton
John Dalton pada awal abad ke-19 menyatakan teorinya tentang teori atom dalton, yaitu
- Unsur tersusun atas partikel yang tidak dapat dibagi lagi yang disebut atom
- Semua atom penyusun unsur yang sama memiliki sifat yang sama (ukuran, bentuk dan massa). Sebaliknya, atom penyusun unsur yang berbeda, memiliki sifat yang berbeda pula.
- Atom-atom dari unsur yang berbeda dapat membentuk molekul dengan perbandingan sederhana
- Pada dasarnya, reaksi kimia adalah suatu penyusunan ulang kombinasi atom dari senyawa pereaksi menjadi susunan atom dalam senyawa hasil reaksi.
3. Model Atom Thomson
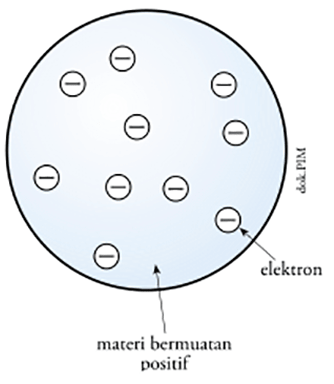
Joseph John Thomson pada 1898 mengemukakan bahwa atom merupakan bola bermuatan positif yang dinetralkan oleh muatan negatif (elektron) yang tersebar merata pada permukaan bola tersebut. Teori atom thomson sering pula disebut sebagai teori roti kismis, yang digambarkan sebagai berikut:
4. Model Atom Rutherford
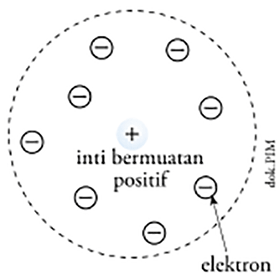
Ernest Rutherford pada 1911 menyatakan bahwa muatan positif suatu atom tidak tersebar merata di seluruh atom, melainkan berkumpul pada pusat atom, yang juga dikenal sebagai inti atom, sementara elektron bergerak mengelilingi inti atom seperti beredarnya planet mengelilingi matahari seperti digambarkan dalam diagram teori atom rutherford berikut:
5. Model Atom Bohr
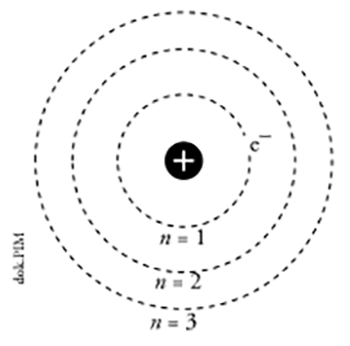
Niels Bohr menyatakan teori atomnya sebagai berikut:
- Atom terdiri atas inti atom bermuatan positif dan elektron bermuatan negatif yang bergerak mengelilingi inti atom
- Elektron bergerak mengelilingi inti atom pada jarak tertentu yang disebut lintasan elektron
- Selama bergerak mengelilingi inti atom, elektron tidak memancarkan atau menyerap energi
- Elektron dapat berpindah ke lintasan yang lebih tinggi dengan menyerap energi dan dapat pula berpindah ke lintasan yang lebih rendah dengan memancarkan energi.
Bila digambarkan, maka teori atom niels bohr adalah sebagai berikut:
6. Model Atom Modern
Model Atom Modern berdasarkan pada teori atom menurut para ahli yang dikemukakan oleh beberapa ilmuwan antara lain Louis de Broglie, Erwin Schrodinger dan Werner Heisenberg. Menurut teori ini atom terdiri atas inti yang terdiri dari 2 jenis nukleon (proton dan neutron) sementara elektron berada di sekeliling inti atom.
Karena kedudukan elektron tidak dapat ditentukan secara pasti, yang dapat dikatakan adalah keboleh jadian (peluang) menemukan elektron yang disebut dengan orbital.
Orbital yang mempunyai tingkat energi yang sama dapat membentuk kulit atom, dimana semakin rendah energinya maka semakin dekat ke inti atom. Secara umum teori atom modern dapat digambarkan sebagai berikut:

Contoh soal dan pembahasan
- Jelaskan mengapa teori dan model atom Rutherford mampu membuktikan bahwa model atom Thomson kurang tepat?
Pembahasan
Teori dan model atom Rutherford melakukan percobaan dengan menggunakan hamburan sinar alfa yang ditembakkan pada lapisan logam emas tipis. Menurut ia, jika teori dan model atom Thomson benar, seluruh sinar alfa akan diteruskan tanpa ada yang dibelokkan. Pada kenyataannya, sinar alfa ada yang dibelokkan, bahkan ada yang dipantulkan membentuk sudut antara 90-180$^{\circ}$. Hasil percobaannya dapat digambarkan sebagai berikut:


